La molécula de agua está compuesta por dos átomos de hidrógeno y uno de oxígeno unidos por un enlace covalente. Es decir, los dos átomos de hidrógeno y el de oxígeno se unen compartiendo electrones. Su fórmula es H2O.
Mediante análisis espectroscópico y de rayos X se ha determinado el ángulo de enlace entre el hidrógeno y el oxígeno, que es de 104.5°, y la distancia media entre los átomos de hidrógeno y oxígeno, que es de 96.5 pm o, lo que es lo mismo, 9.65·10-8 milímetros.
 La disposición de los electrones en la molécula de agua le comunica asimetría eléctrica por la diferente electronegatividad del hidrógeno y del oxígeno. La electronegatividad es la capacidad de un átomo para atraer los electrones compartidos en un enlace covalente.
La disposición de los electrones en la molécula de agua le comunica asimetría eléctrica por la diferente electronegatividad del hidrógeno y del oxígeno. La electronegatividad es la capacidad de un átomo para atraer los electrones compartidos en un enlace covalente.
Como el oxígeno es más electronegativo que el hidrógeno, es más probable que los electrones, que poseen carga negativa, estén más cerca del átomo de oxígeno que del de hidrógeno, lo cual provoca que cada átomo de hidrógeno tenga una cierta carga positiva que se denomina carga parcial positiva, y el de oxígeno, una negativa, ya que tiene los electrones más cerca. Esto significa que el agua es una molécula polar, pues tiene una parte o polo negativa y otra positiva, aunque el conjunto de la molécula es neutro. De este carácter polar derivan casi todas sus propiedades fisicoquímicas y biológicas.
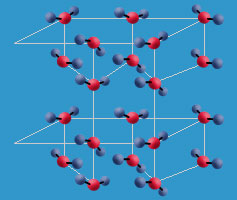
Cuando dos moléculas de agua están muy cerca entre sí se establece una atracción entre el oxígeno de una de las moléculas, que tiene carga parcial negativa, y uno de los hidrógenos de la otra molécula, que tiene carga parcial positiva. Una interacción de este tipo se denomina enlace o puente de hidrógeno, y las moléculas de agua se ordenan de tal modo que cada molécula puede asociarse con otras cuatro. Esta interacción es la que se da con el hielo.
Estos enlaces de hidrógeno se forman entre un átomo con carga parcial negativa y un hidrógeno con carga parcial positiva, por lo que no son exclusivos del agua. Se da también entre el nitrógeno, o el flúor, y el hidrógeno en otras moléculas como proteínas o el ADN.
En cuanto a las propiedades fisicoquímicas del agua podemos destacar la gran capacidad disolvente, su elevado calor específico y elevado calor de vaporización, gran cohesión y adhesión, densidad anómala y reactivo químico.
 El agua es capaz de dispersar a un elevado número de compuestos en su seno debido a su carácter polar. Así, con las sales, que son sustancias iónicas, la molécula de agua orienta sus polos en función de las cargas de los iones, oponiendo el polo negativo a los iones positivos (cationes de la sal) y el polo positivo a los iones negativos (aniones de la sal). Con sustancias polares, como el etanol, el agua actúa de modo parecido, oponiendo un polo frente al polo de signo contrario de la sustancia.
El agua es capaz de dispersar a un elevado número de compuestos en su seno debido a su carácter polar. Así, con las sales, que son sustancias iónicas, la molécula de agua orienta sus polos en función de las cargas de los iones, oponiendo el polo negativo a los iones positivos (cationes de la sal) y el polo positivo a los iones negativos (aniones de la sal). Con sustancias polares, como el etanol, el agua actúa de modo parecido, oponiendo un polo frente al polo de signo contrario de la sustancia.
El calor específico es la cantidad de calor que hay que administrar a un gramo de agua para elevar 1ºC su temperatura, mientras que el calor de vaporización es la cantidad de calor que hay que aplicar a un gramo de líquido para que pase a un gramo de vapor. El agua tiene elevado calor específico y de vaporización debido a los puentes de hidrógeno, ya que para elevar su temperatura, las moléculas de agua tienen que aumentar su vibración y, para ello, romper enlaces de hidrógeno, mientras que para pasar un gramo de vapor.
El agua tiene elevado calor específico y de vaporización debido a los puentes de hidrógeno, ya que para elevar su temperatura, las moléculas de agua tienen que aumentar su vibración y, para ello, romper enlaces de hidrógeno, mientras que para pasar un gramo de líquido a vapor también hay que romper puentes de hidrógeno.
| PRESIÓN DE VAPOR Y TENSIÓN SUPERFICIAL DEL AGUA EN CONTACTO CON EL AIRE | ||
| Temperatura ºC | Presión vapor mm/Hg | Tensión superf dinas/cm |
| 0 | 4.58 | 75.6 |
| 5 | 6.54 | 74.9 |
| 10 | 9.21 | 74.2 |
| 15 | 12.8 | 73.5 |
| 20 | 17.5 | 72.8 |
| 25 | 23.8 | 72.0 |
| 30 | 31.8 | 71.2 |
| Fuente: La enciclopedia del medio ambiente urbano | ||
La cohesión es la tendencia de dos moléculas a estar unidas, y el agua tiene alta cohesión debido a sus puentes de hidrógeno. La adhesión es la tendencia de dos moléculas distintas a unirse, y el agua tiene elevada adhesión hacia compuestos iónicos y polares.
El hielo tiene una densidad menor que el agua líquida y, por ello, flota, lo que implica importantes consecuencias biológicas en la ecología de los organismos acuáticos. El agua puede reaccionar con otros compuestos mediante reacciones de hidrólisis, hidratación, etc.
Además, el agua en disolución se ioniza en pequeña proporción, produciéndose el siguiente equilibrio:
H2O ‹ – › H3O+ + OH–
Este equilibrio constituirá la base para la escala de pH.
La idoneidad del entorno acuoso para los seres vivos es consecuencia de estas propiedades fisicoquímicas. Por ejemplo, los compuestos reaccionan mejor cuanto más disgregados estén, lo que se favorece en medio acuoso para compuestos iónicos y polares.
El agua, por su elevado calor específico, permite que la temperatura del organismo permanezca relativamente constante aunque varíe la temperatura ambiente, mientras que por su elevado calor de vaporización permite que los vertebrados tengan un medio eficaz para perder calor mediante la evaporación del sudor.
| VISCOSIDAD Y DENSIDAD DEL AGUA | ||||
| Temperatura ºC | Densidad gramos/cm3 | Viscosidad absoluta centipoises | Viscosidad cinemática centistokes | Temperatura ºF |
| 0 | 0.99987 | 1.7921 | 1.7923 | 32.0 |
| 2 | 0.99997 | 1.6741 | 1.6741 | 35.6 |
| 4 | 1.00000 | 1.5676 | 1.5676 | 39.2 |
| 6 | 0.99997 | 1.4726 | 1.4726 | 42.8 |
| 8 | 0.99988 | 1.3872 | 1.3874 | 46.4 |
| 10 | 0.99973 | 1.3097 | 1.3101 | 50.0 |
| 12 | 0.99952 | 1.2390 | 1.2396 | 53.6 |
| 14 | 0.99927 | 1.1748 | 1.1756 | 57.2 |
| 16 | 0.99897 | 1.1156 | 1.1168 | 60.8 |
| 18 | 0.99862 | 1.0603 | 1.0618 | 64.4 |
| 20 | 0.99823 | 1.0087 | 1.0105 | 68.0 |
| 22 | 0.99780 | 0.9608 | 0.9629 | 71.6 |
| 24 | 0.99733 | 0.9161 | 0.9186 | 75.2 |
| 26 | 0.99681 | 0.8746 | 0.8774 | 78.8 |
| 28 | 0.99626 | 0.8363 | 0.8394 | 82.4 |
| 30 | 0.99568 | 0.8004 | 0.8039 | 86.0 |
| Fuente: Internacional Critical, Tables, 1.928 y 1.929 | ||||
El agua presenta también una elevada cohesión y adhesión. Esta propiedad del agua es explotada por las plantas superiores para el transporte de los elementos nutritivos en disolución desde las raíces hasta las hojas.
El agua interviene entre otras en reacciones de hidrólisis, características de la proteína en los procesos digestivos como la rotura del enlace peptídico entre aminoácidos:
Grupo de Tratamiento de Aguas Residuales. Escuela Universitaria Politécnica. Universidad de Sevilla.












